




人体由200多种细胞组成,这些细胞都由单个受精卵发育而来。
胚胎干细胞来自早期胚胎,具体来说是植入前囊胚的内细胞团,具有发育成人体所有细胞的潜能,而外面的滋养层细胞发育成胎盘。
因此,胚胎干细胞也被称为全能干细胞,理论上可以再生人体所有细胞。
1、研究历史
1981年,英国科学家马丁•约翰•埃文斯爵士建立首株小鼠胚胎干细胞系,并因为这项工作获得2007年诺贝尔奖。
1998年,美国的James A. Thomson建立首株人胚胎干细胞系,为胚胎干细胞的临床应用奠定基础。
2006年,日本的山中伸弥教授发现通过过表达四个基因(Oct4、Sox2、Klf4、c-Myc),可以将小鼠的成纤维细胞重编程为类似胚胎干细胞样的细胞,即iPS细胞。
1年后,科学家(包括山中伸弥、James A. Thomson的实验室)成功获得人iPS细胞。山中伸弥教授也由于该发现获得2012年的诺贝尔奖。
胚胎干细胞和iPS细胞都属于全能干细胞,具有分化成人体所有细胞的潜能,因此在临床上具有最广阔的应用前景。

△从左至右依次为马丁•约翰•埃文斯爵士、James A. Thomson和山中伸弥
2、胚胎干细胞临床研究现状
尽管全能干细胞的应用前景很美好,而且相关研究两次获得诺贝尔奖,但是现实很残酷,目前进入临床试验阶段的胚胎干细胞项目屈指可数。
2009年,美国FDA批准加州的杰龙(Geron)公司开展世界上首个胚胎干细胞临床试验,利用胚胎干细胞分化成的少突胶质前体细胞治疗脊髓损伤1。首例病人于2010年接受治疗2。然而2011年,在完成5例病人治疗后,杰龙公司终止该项目3,给胚胎干细胞临床研究领域当头一棒。
尽管杰龙公司官方解释是公司业务重点转移到肿瘤药物研发,但深谙这个行业的人士明白更重要的原因是胚胎干细胞治疗项目研发的难度超乎想象。
杰龙公司并未发表临床研究的相关论文,因此首批病人的确切疗效尚不清楚。从杰龙公司在学术会议上披露的信息推断,治疗本身安全性较高,但疗效并不显著。
2013年,杰龙公司将相关技术卖给BioTime公司4,后者继续进行该项目。
值得一提的是,BioTime公司目前的CEO是Michael D. West,同时也是杰龙公司的创始人,他继续该项目至少部分出于这种特殊的情愫。
2010年,美国FDA批准先进细胞技术公司(Advanced Cell Technology,ACT)开展第2例胚胎干细胞临床试验5,利用胚胎干细胞分化成的视网膜色素上皮细胞治疗黄斑变性(包括斯特格黄斑变性和老年黄斑变性)。
该项目的首席科学家是Robert Lanza 博士,曾获得2014年《时代》杂志世界百位最有影响力人物提名。
2012年,该公司在《柳叶刀》杂志报道2例接受治疗病人的情况,指出治疗安全性较高,病人视力没有进一步恶化,部分抵消了杰龙终止临床试验的负面影响。
2014年,ACT更名为Ocata Therapeutics,并于2015年被日本的Astellas Pharma收购,为产品研发注入资金。
2015年,Robert Lanza 博士的团队在《柳叶刀》杂志报道了18位接受治疗病人的情况,发现10位视力得到改善,7位变化不大,只有1位视力出现恶化。
和前面两家经常占据新闻头条的公司相比,第3家公司比较低调。
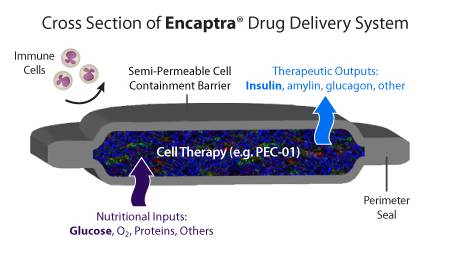
2014年,美国FDA批准ViaCyte公司开展胚胎干细胞分化成的胰腺β细胞治疗糖尿病7。除了胚胎干细胞分化技术平台,这家公司还有一件秘密武器,即细胞胶囊化技术。
胚胎干细胞分化成的胰腺β细胞被包裹在胶囊内,避免受体免疫系统攻击移植物。
相比脊髓损伤和黄斑变性,胚胎干细胞分化成的胰腺β细胞只要具备分泌胰岛素的能力,就可以缓解甚至治愈糖尿病患者。
而在前两种疾病中,移植的细胞不仅需要替代损伤的细胞,还要和已有神经网络完美整合,难度更大。因此,第3项临床试验成功的可能性最高。另外,由于I型糖尿病患者众多,该产品的市场前景广阔,不会出现部分细胞治疗产品“叫好不叫座”的尴尬境地。
由于相对宽松的伦理环境,我国胚胎干细胞研究的大环境不算差。
遗憾的是,由于各种原因(包括自主药物研发经验缺乏、社会资本投入不够、法规监管不清晰等),胚胎干细胞的临床研究直到最近才姗姗来迟。
今年,我国科学家(周琪院士团队)开展胚胎干细胞分化成的神经前体细胞治疗帕金森氏综合症和老年黄斑变性的临床研究8。希望我国能在该领域后来居上!
3、iPS细胞临床研究现状
由于山中伸弥的明星效应,日本在iPS领域投入最大。
目前国际上唯一1例iPS细胞的临床应用来自日本。
2014年,日本的Masayo Takahashi团队利用病人自身的iPS细胞分化成的视网膜色素上皮细胞治疗黄斑变性9。
1年后,由于计划接受移植患者来源的iPS细胞出现基因突变,出于安全考虑,该团队终止了临床试验10。iPS细胞临床应用的前景一下变得黯淡。
今年年初,该领域出现转机。
日本批准Masayo Takahashi团队开展异体iPS细胞的临床试验,仍然是iPS细胞分化成的视网膜色素上皮细胞治疗黄斑变性11。
和最初设想的不同,iPS细胞临床应用的重点从自体转到异体,而iPS技术发明的初衷是解决异体移植免疫排斥问题。
造成该转变有多种原因,最重要的是经济因素。日本首例iPS临床试验花费将近100万美元,即使将来技术成熟会降低成本,自体iPS技术大规模应用对医保系统来说注定难以为继。
4、未来展望
通过回顾全能干细胞临床研究现状,可以总结出几条经验,并对该领域未来发展方向做出预测:
一、 iPS细胞和胚胎干细胞会共同发展,而不是二选一
iPS细胞最大的优势是可以获得病人特异的全能干细胞,移植给病人时不会产生免疫排斥。
然而,随着研究的深入,科学家发现iPS细胞和胚胎干细胞还是存在一些差异。
由于重编程不完全,iPS细胞会带有起始细胞的印记,即心肌细胞来源的iPS细胞更容易分化成心肌细胞,而向其他类型细胞分化的能力受到一定影响。
另外,为了获得iPS细胞而转入外源基因,增加有害基因突变的风险。
因此,iPS细胞在临床上的优势是没有免疫排斥,但质量和安全性不如胚胎干细胞。
由于这两种细胞各有优势,因此相应的临床研究都会开展,不会出现一边倒的局面。
二、覆盖大部分人群的干细胞库的建设是全能干细胞临床应用的重要环节
由于获得高质量的病人特异的iPS细胞需要耗费大量的时间和金钱,目前就连iPS技术的先驱日本也放弃这条路线,转走异体iPS细胞,建立覆盖日本大部分人群HLA位点的iPS细胞库。
周琪院士团队也采用类似的策略,通过建立大量的胚胎干细胞系,以覆盖尽可能多的人群。
由于我国人口数量更多,民族成份更加复杂,该策略的难度很大。
2017年,该团队获得国家干细胞重大专项支持,以攻克该难题。
三、功能性细胞及组织分化是全能干细胞临床应用的最大障碍
十月怀胎,受精卵发育成个体经历漫长的过程。
全能干细胞分化成功能性细胞相当于体外重现这一过程,难度很大。经过多年的研究,目前科学家已经报道多个全能干细胞的分化方案。
然而,绝大多数方案仍然存在以下缺陷:分化效率不高,目标细胞得率低;终产物中残留少量全能干细胞,存在致瘤风险;分化细胞成熟度不够,影响生理功能。更大的挑战来自细胞如何在体外组装成组织甚至器官、移植物如何和受体有效整合等。发育生物学、组织工程、3D打印等学科的进展都将推动全能干细胞临床研究的进步。
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
