




2016年FDA共批准22个原创新药,包括15个新分子实体和7个新生物制品,其中15个以优先审评(P)的方式获得批准。从企业角度看,罗氏、默沙东、礼来、Biogen均有2个新药获批。
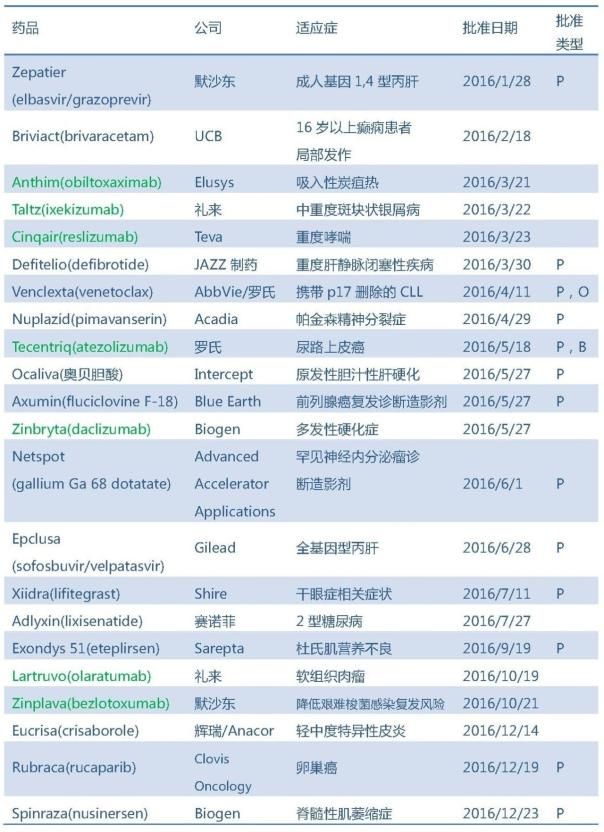
注:绿色代表新生物制品
1、Zepatier,默沙东
FDA 1月28日以优先审评方式批准Zepatier(elbasvir 50mg/grazoprevir 100mg)用于治疗基因1,4型丙肝。基因1型是患者数量最多的丙肝类型,美国近400万丙肝患者中75%是基因1型。
Zepatier是最早获得突破性药物资格的丙肝药物之一,不过随着Solvadi(2013/12/6)和Viekira Park(2014/12/19)的快速上市,FDA认为默沙东和BMS的丙肝药物相比现有疗法不再具有突破性意义,遂于2015年2月取消了它们的突破性药物资格。但是因为基因4型丙肝、合并终末期肾病正在进行血液透析治疗的基因1型丙肝的医疗需求仍远未得到满足,FDA又于2015年4月在这个两个适应症上授予了Zepatier突破性药物资格。多项临床研究结果显示,Zepatier实现了更高的持续病毒学应答率,将基因1型丙肝的SVC12从94%提高到97%,将基因4型丙肝的SVC12从97%提高到100%。
Zepatier批准的疗程有12周和16周两种,具体治疗周期取决于HCV基因分型和治疗史,对于基因1型丙肝患者,还跟基线时的NS5A基因多态性有关,不多对于大多数选择Zepatier的丙肝患者,一般都只需要12周。
2、Briviact,UCB制药
美国FDA 2月18日批准Briviact (brivaracetam) 作为其他药物的附加药物治疗16岁以上癫痫患者的局部发作。Briviact 的有效性在3项涉及1550例患者的临床研究中得到证实。Briviact联合其他药物能够有效地降低癫痫的发作频率。 Briviact最常见的副作用包括嗜睡、 头晕、 疲劳、 恶心、 呕吐。
癫痫是一种常见疾病,其特征在于疾病反复发作,伴有不受控制移动、肌肉痉挛和行为异常在内的典型症状。全球约有5000万癫痫患者,每年新增200万癫痫患者。美国大约有500万癫痫患者。中国目前约有1000万癫痫患者,其中600多万为有发作的患者,每年新增癫痫患者40万。在癫痫患者中,儿童和青少年仍是癫痫高发人群。
3、Anthim,Elusys Therapeutics
FDA 3月21日批准Elusys Therapeutics公司的Anthim (obiltoxaximab) 注射液与特定抗生素联用,用于治疗吸入性炭疽感染,以及在不适合替代疗法时预防吸入性炭疽热。FDA 曾在去年11月23日批准Emergent BioDefense Operations公司的一款疫苗产品BioThrax与特定抗生素疗法联用,用于疑似或确诊炭疽暴露后的炭疽热预防。BioThrax也是第一款仅凭借动物实验数据就获得FDA批准的疫苗产品。
4、Taltz,礼来
FDA 3月22日批准Taltz (ixekizumab)注射液80mg/ml,用于治疗适合全身疗法和光疗的中重度银屑病成人患者。ixekizumab禁用于既往对ixekizumab或任何辅料成分发生过超敏反应的患者。Taltz已于今年2月获得欧盟CHMP的推荐批准,是继诺华Cosentyx之后全球第2个获批上市的anti-IL17A单抗。
银屑病是一种慢性、自身免疫性皮肤疾病,全球患病人数大约为1.25亿。目前虽然有多个药物获批治疗银屑病,但由于银屑病无法治愈,现有药物只能改善疾病症状,因此银屑病药物市场是非常有“钱景”的一个领域。
5、Cinqair,Teva
FDA 3月23日日批准Teva公司哮喘新药Cinqair(reslizumab),用于以吸入性糖皮质激素(ICS)为基础治疗方案但病情控制不佳的血液嗜酸性粒细胞水平升高的18岁以上重度哮喘患者的维持治疗。
Reslizumab是继葛兰素史克mepolizumab(2015/11/4 获批) 之后FDA批准的第2款anti-IL5单抗药物。但FDA未批准reslizumab用于12-17岁青少年哮喘患者。
哮喘是一种呼吸道慢性炎症,据美国疾病控制中心数据,2013年在美国有超过2200万哮喘患者,每年哮喘相关住院病例多达40万。在哮喘患者中,血液嗜酸性粒细胞水平升高(≥400个细胞/μL)与肺功能受损、持续的症状、急性发作风险的升高相关。reslizumab被认为能够结合并中和IL-5,减少嗜酸性粒细胞炎症。
6、Defitelio,JAZZ制药
FDA 3月30日批准JAZZ制药公司Defitelio (去纤维蛋白多核苷酸) ,用于治疗成人及儿童患者接受血液或骨髓造血干细胞移植(HSCT)后发生的肝静脉闭塞性疾病(VOD)合并肾脏或肺功能异常。这是FDA批准的首个治疗重度肝静脉闭塞性疾病治疗药物。Defitelio是Jazz在2013年10亿美元收购意大利药企Gentium时获得的药物。
肝静脉阻塞是一种罕见却致命的疾病,通常见于那些接受过高剂量化疗以及血液干细胞移植的血癌患者。肝静脉阻塞(VOD)的症状为肝血管阻塞,进而导致肝内血液交换减少和肿胀,这会造成肝损伤,还有可能累及肾脏和肺功能。接受血液干细胞移植的人群的2%会出现这类并发症,而其中80%都是致命的。美国卫生资源和服务管理局在2013年发布的数据表明,每年美国会实施18000例骨髓或脐带血移植。
7、Venclexta,AbbVie/罗氏
Venclexta 于4月11日获得FDA加速批准,用于单药治疗既往接受过治疗的携带p17删除的慢性淋巴细胞白血病(CLL)。Venclexta在这个适应症上获得过FDA授予的突破性药物资格,是 FDA批准的首个BCL-2抑制剂。
CLL是最常见的成人白血病,美国每年约有 15000 新诊断病例。CLL 的特点是异常淋巴细胞进展性累积, p17删除约占未经治疗 CLL 的 10%,占复发 CLL 的 20%。 p17删除造成抑癌基因的缺失,是最难治疗的一类 CLL。
8、Nuplazid,Acadia
Nuplazid是FDA批准的首个治疗帕金森病性精神病的药物,是帕金森病性精神病临床治疗的重大里程碑。
Nuplazid是FDA批准的首个选择性靶向5-HT2A受体的药物,这些受体在帕金森病性精神病中发挥着重要作用。Nuplazid不仅优先靶向5-HT2A受体,同时可避免多数精神分裂症药物所具有的多巴胺受体及其他受体激活副作用。
据美国国立卫生研究院(NIH)数据,美国每年确诊为帕金森症的患者多达50000例,整个美国大约有100万例帕金森患者。全球范围内大约有400-600万帕金森患者。多达40%的帕金森患者伴有帕金森性精神病,其特征为幻觉和妄想,为其照料者及家庭带来了沉重的负担。
9、Tecentriq,罗氏
FDA 5月18日宣布批准罗氏PD-L1单抗Tecentriq (atezolizumab),用于治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌患者。Tecentriq在3月15日获得了FDA授予的优先审评资格,比预定的PDUFA审批期限(Tecentriq)提前了近4个月,是FDA批准的首个PD-L1单抗。
尿路上皮癌占所有膀胱癌的90%,也可见于肾盂、输尿管和尿道。2016年美国新确诊膀胱癌患者预计76960例,死亡病例为16390例。早期阶段确诊的膀胱癌患者的5年生存率大约为96%,而晚期阶段确诊的膀胱癌患者5年生存率仅为39%。Tecentriq成为首个获批治疗这一最常见类型膀胱癌的PD-1/PD-L1抑制剂。
10、Ocaliva,Intercept
FDA 5月27日加速批准Ocaliva(奥贝胆酸),联合熊去氧胆酸(UDCA)用于UDCA单药治疗响应不足的原发性胆汁性肝硬化成人患者,或单药用于无法耐受UDCA的PBC成人患者。
原发性胆汁性胆管炎(PBC)是一种肝内胆小管渐进性损伤的慢性疾病,主要是因胆管遭到自身免疫性破坏,导致胆汁淤积。它主要影响女性,目前是美国女性进行肝脏移植手术的第二大病因。在欧洲,该病约占胆汁淤积性疾病所致肝移植病例的一半左右,约占所有肝移植病例的6%。
UDCA是目前唯一获批治疗PBC的药物。UDCA可有效治疗超过50%的患者。然而,多达40%的患者的ALP水平或总胆红素不会降低,且5%~10%的患者无法耐受UDCA。
FDA曾授予Ocaliva优先审查资格。OCA是一种法尼酯X受体激动剂,可促进胆汁酸的释放,开发用于原发性胆汁性肝硬化、非酒精性脂肪性肝炎及其他肝脏疾病和肠道疾病的治疗。此前,FDA已授予OCA治疗伴有肝纤维化的NASH的突破性药物资格、治疗PBC的快车道地位、治疗PBC和PSC的孤儿药地位。
11、Axumin,Blu Earth
Axumin(可注射放射性诊断试剂)5月27日获得FDA批准,用于前列腺癌复发的检测。适应于治疗后PSA升高,PET检查可疑前列腺癌复发的患者。
Axumin的活性成分为fluciclovineF18,化学名为[18F]-1-氨基-3-氟环丁烷-1-甲酸,是一种非天然氨基酸,可被位于前列腺癌细胞表面的氨基酸转运体吸收至癌细胞内,前列腺癌细胞比其周围的健康组织更易于吸收fluciclovine F18,且在吸收后不会将其代谢或用于蛋白质合成。
Axumin显像剂吸收分布较好,半衰期适当,与其他两种诊断试剂相比,可以更精确地确定前列腺癌复发病灶的位置。
Axumin 是一种放射性药物,应采用适当的安全措施处理,以在使用期间使患者及医疗保健提供者最小程度地暴露于放射中。Axumin 用于正电子成像术时会发生影像判读错误。
12、Zinbryta,Biogen/罗氏
FDA 5月27日批准了Biogen/AbbVie的Zinbryta(daclizumab)用于治疗复发缓解型多发性硬化症(RRMS)。Zinbryta是靶向CD25的人源化单克隆抗体药物,患者可自行给药且每个月只需注射1次,是目前给药周期间隔最长的注射用MS药物。
需要注意的是,Zinbryta的药品标签中附有黑框警告,警示医疗保健人员该药可能会引起威胁生命或致命性的严重肝损伤以及严重的免疫性疾病(如结肠炎症、淋巴结肿大、过敏反应)的安全性风险,一般情况下,Zinbryta只适用于对2种以上多发性硬化症治疗药物响应不足的成人患者。
Zinbryta的药品标签中还提供了风险评估与减轻策略(RESM)的信息,医疗保健人员应监测患者的肝功能,患者在每次注射Zinbryta之前都应进行血检,并且在最后1次注射Zinbryta后坚持监测6个月。
13、Netspot
NetSpot是一种无菌、静脉内注射使用的单剂量镓68 DOTATATE试剂盒,用于正电子发射断层扫描成像(PET)。这种放射性探针可以帮助定位患有罕见的生长抑素受体阳性的神经内分泌肿瘤(NETs)成人和儿童患者中的肿瘤。
Ga 68 dotatate的吸收水平反映了神经内分泌肿瘤(NETs)中生长抑素受体的密度。这种吸收也可以在其他各类肿瘤或其他病例条件下观察到,Ga 68 dotatate的吸收可能需要通过组织病理学或其他评估措施确定。
14、Epclusa,Gilead
FDA 6月28日批准了Gilead公司的Epclusa(索非布韦+ velpatasvir)(SOF+VEL),与利巴韦林联用治疗伴有或无晚期肝病的基因1~6型丙肝病毒(HCV)感染。Epclusa是由索非布韦和velpatasvir 组成的固定剂量复方,是首个获批治疗全部6种基因型HCV感染的药物,市场表现极其惊人。
Epclusa的药品标签中带有警告,提示胺碘酮与索非布韦联用可能会导致严重心动过缓并需要起搏治疗。因此不推荐Epclusa与胺碘酮同时服用。
15、Xiidra,Shire
干眼症(dry eye)又名角结膜干燥症(KCS),是指任何原因造成的泪液分泌不足或泪液动力学异常,导致泪膜稳定性下降,并伴有眼部不适和(或)眼表组织病变特征的多种疾病的总称。
干眼症是目前最为常见的眼表疾病,发病率与年龄和性病有关,30~40岁成人发病率为5%,65岁以上老人的发病率为10%~15%,女性发病率高于男性。美国大约有2900万干眼症患者。
Xiidra( Lifitegrast)属于first in class的淋巴细胞功能相关抗原-1(LFA-1)拮抗剂。LFA-1是存在于白细胞表面的一种蛋白。在干眼症中,ICAM-1在角膜和结膜组织中过量表达。LFA-1/ICAM-1相互作用促进免疫突触的形成,导致T细胞激活并迁移至目标组织。
lifitegrast是Shire在2013年花费了1.6亿美元从美国SARcode Bioscience收购而来,被预测销售峰值可超过10亿美元,获得过FDA的优先审评资格。lifitegrast的上市之路并不平坦,Shire在去年10月收到了FDA的CRL,并补做了一项名为OPUS-3的III期临床研究来回答CRL中的各项问题。
16、Adlyxin,赛诺菲
Adlyxin(lixisenatide)是继艾塞那肽(阿斯利康)、利拉鲁肽(诺和诺德)、阿必鲁肽(GSK)和度拉鲁肽(礼来)之后全球第5个上市的GLP-1受体激动剂。不过最近上市的阿必鲁肽和度拉鲁肽都属于每周注射1次的长效制剂。
Lixisenatide最常见的治疗相关不良反应主要包括恶心、呕吐、头痛、腹泻和头晕,以及与磺酰脲和基础胰岛素类似的低血糖症。另外,临床研究中也有接受Lixisenatide治疗患者发生全身性过敏的报告。Lixisenatide禁用于1型糖尿病患者以及酮酸水平增高的患者。
FDA同时要求赛诺菲开展Adlyxin的上市后研究,包括考察Lixisenatide在儿童患者中的剂量、疗效和安全性,以及考察Lixisenatide的免疫原性。
17、Exondys 51,Sarepta
杜氏肌营养不良是一种尚无法治愈的侵袭性、退行性遗传疾病,每3600名新生男婴中,将会有一名男婴受到此病的影响。DMD妨碍肌肉运动,极易引发早期死亡和高风险的心脏-呼吸衰竭,临床上唯一有效的治疗手段是糖皮质激素类固醇药物,类固醇有严重的副作用,不能长期服用。在不经治疗干预的情况下,患者会在十几岁的时候完全丧失行走能力,在20~30岁左右丢掉性命。
Exondys 51(eteplirsen)注射液之前也被FDA咨询委员会投票否决过,但获得过孤儿药资格、快速通道资格、优先审评资格的eteplirsen最终还是凭借可以使肌营养蛋白含量增加0.28%的替代终点获得FDA加速批准。
Exondys 51是FDA 批准的首个杜氏肌营养不良(DMD)新药,用于确认携带肌营养蛋白基因第51号外显子跳跃突变的DMD患者。据统计,DMD患者中有13%存在51号外显子跳跃突变。
18、Lartruvo,礼来
软组织肉瘤是起源于脂肪、筋膜、肌肉、纤维、淋巴及血管等组织的恶性肿瘤。据美国癌症研究所统计,2016年美国将有12310例新确诊病例和5000例死亡病例。对于无法手术的软组织肉瘤患者,最常见的治疗药物是多柔比星或其他药物。
olaratumab是一种血小板源性生长因子受体α(PDGF-Rα)单抗,可通过抑制PDGF-R的激活来抑制肿瘤生长。
FDA授予过Lartruvo孤儿药资格,以及在上述适应症上的快速通道资格、突破性药物资格和优先审评资格。FDA 10月19日加速批准Lartruvo(olaratumab),联合多柔比星用于不合适放射治疗或手术但适合蒽环类药物的特定类型软组织肉瘤。礼来还需要开展后续研究,向FDA提供更多的有效性证据。
19、Zinplava,默沙东
Zinplava(bezlotoxumab)是一种单抗药物,其作用不是直接杀菌,而是中和艰难梭菌毒素B,后者会对小肠壁造成损伤,从而引发腹泻。默沙东2009年以 6000 万美元预付款及 1.65 亿美元里程金从Medarex获得了Zinplava的开发授权。BMS之后以24亿美元收购了Medarex。
约四分之一的艰难梭菌感染患者在首次发作后出现复发,其中超过40%的患者后再次发生复发,这表明需要继续寻找能够打破感染周期循环的新方法。
据美国CDC的数据显示,仅2011年,美国近50万人发生艰难梭菌在感染,其中29000例在初诊后30天内死亡。
默沙东表示最早于2017上半年将该药推向市场,瑞士信贷预测该药物有望在2020年之前达到3亿美元的销售额。
20、Eucrisa,辉瑞/Anacor
过敏性皮炎是一种常见的复发性慢性炎性皮肤疾病,患者通常表现为以炎症和瘙痒为特点的慢性皮疹,好发于皮肤褶皱处,症状通常会持续14天以上,影响1800万~2500万美国人,其中婴儿和儿童占8%~18%。过敏性皮炎缺少有效的治疗药物,FDA过去15年未曾批准一个治疗过敏性皮炎的新分子实体。
Eucrisa(crisaborole)是一种含硼的小分子抗炎药,属于非甾体PDE4抑制剂,治疗过敏性皮炎的作用机制尚未完全阐明。
辉瑞在2016年5月17日与Anacor达成交易,以52亿美元全现金收购Anacor,将crisaborole收入囊中。辉瑞计划将在明年1月推出该产品,出厂价580美元/管(60克)。Eucrisa预测年销售峰值可达20亿美元。
21、Rubraca,Clovis Oncology
Rubraca(rucaparib)是全球第2个上市的PARP抑制剂,用于单药治疗既往接受过两种以上化疗的BRCA突变晚期卵巢癌。
PARP是一个独特的靶点,可以抑制DNA修复。肿瘤细胞在复制时依然需要保持DNA的相对完整,同样离不开DNA修复。不过正常细胞体内存在多条DNA修复的信号通路,而肿瘤细胞有时会发生突变破坏其他DNA修复通路(DNA修复缺陷型肿瘤细胞),因此抑制PARP这个靶点对于某些突变类型肿瘤具有很好的疗效。
在赛诺菲的第一个“乌龙”PARP抑制剂死在III期之后,众多在该靶点布局的制药巨头丧失信心,默沙东把niraparib卖给了Tesaro,BioMarin把talazoparib卖给Medivation,Clovis的这个Rucaparib原本也是辉瑞的资产。
随着niraparib一夜爆红之后,PARP这个靶点引发了大家的广泛关注,不仅Medivation有了与收购方谈判的强力筹码,rucaparib也拯救了飘飘欲坠的Clovis。
22、Spinraza,Biogen
SMA是一种罕见的致命性遗传病,主要影响肌肉力量和运动,患者主要表现为全身肌肉萎缩无力,身体逐渐丧失各种运动功能,甚至是呼吸和吞咽。发病年龄、症状和进展速率具有很大的变异性。
SMA是2岁以下婴幼儿群体中的头号遗传病杀手,在新生儿中的患病率为1:6000-1:10000,中国大约有患儿3~5万人。
Spinraza是一种反义寡核苷酸,可改变SMN2基因的剪接,增加全功能性SMN蛋白的生产,是全球首个获批治疗脊髓性肌萎缩症的药物。Spinraza此次是以加速批准方式获得FDA批准,审评周期仅3个月。(来源:医药魔方)
相关新闻
博雅新闻

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
