




本文重点摘要
青光眼作为不可逆致盲眼病,传统治疗仅能控制眼压,却无法修复受损的视神经。近年来,干细胞外泌体的突破性研究正改变这一困境。研究表明: (1) 干细胞外泌体能够穿越血-视网膜屏障,发挥神经保护,再生小梁网状结构以及免疫调节及抗炎等作用,为全球数百万青光眼患者提供一种新颖、有针对性的视力保护方法。 (2)在临床中,玻璃体内注射间充质干细胞衍生的外泌体,促进了视网膜神经节细胞(RGCs)的神经保护作用。 (3)研究中,源自于自视网膜祖细胞系R-28的细胞外囊泡使视网膜神经节细胞存活率提高35.08% (4)工程化外泌体可增强药物稳定性、实现可控释放以及改善对眼组织的靶向递送。
青光眼是一种常见眼病,核心问题是眼压出现病理性升高 —— 简单说就是眼内压力超出正常范围且持续异常,这种高压会慢慢损伤视神经,还会导致视野逐渐缩小,这是这类眼病的共同特点。
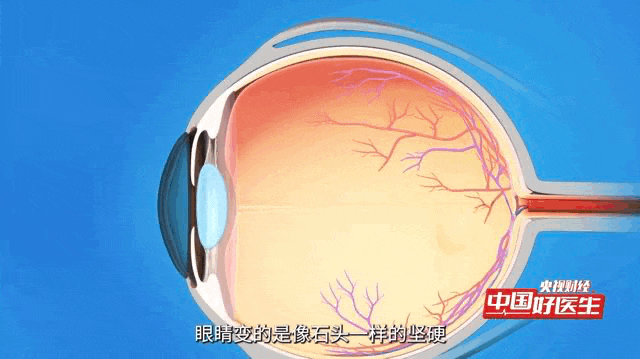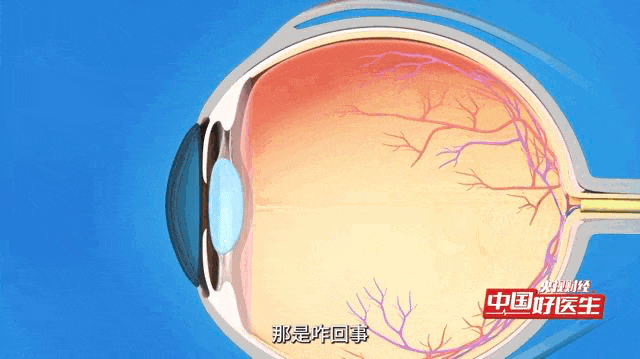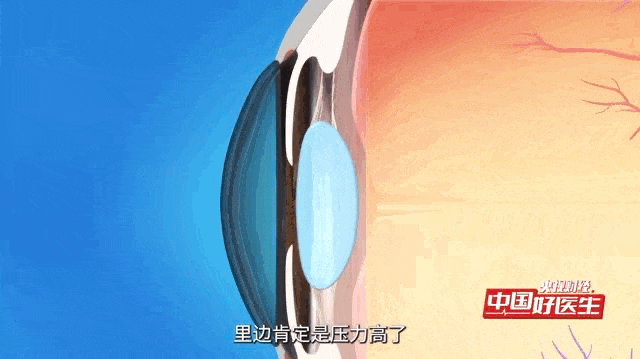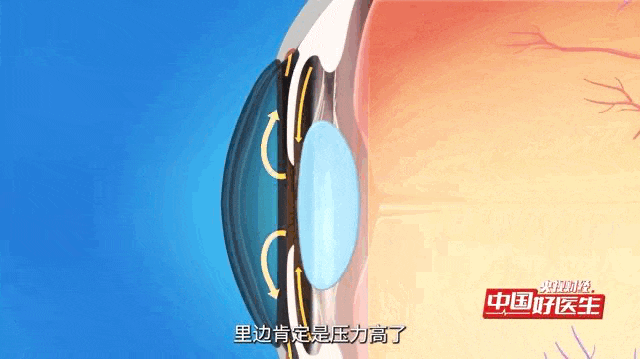


青光眼被称为“视力的小偷”的疾病,已成为全球首位不可逆性致盲眼病。据统计,全球有数千万人遭受青光眼的困扰,而中国的青光眼患者数量尤为庞大,且逐年增长。

传统上,医生们主要通过药物、激光和手术来控制眼压,却无法修复已受损的视神经细胞。
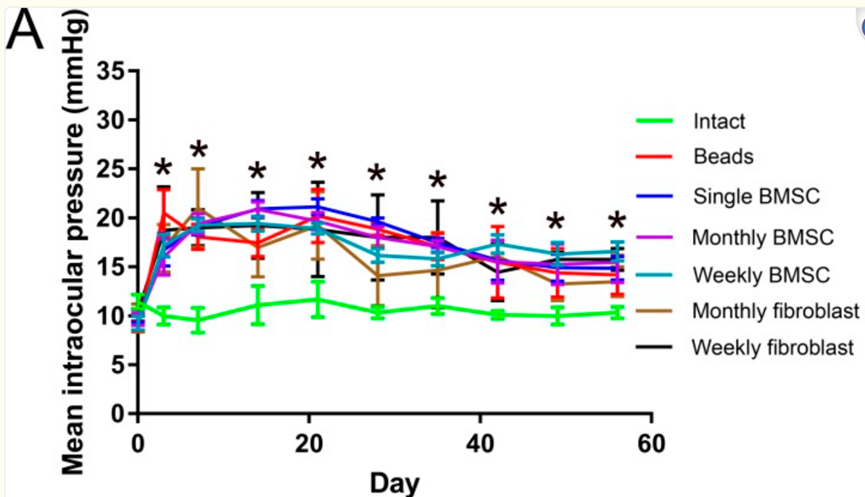
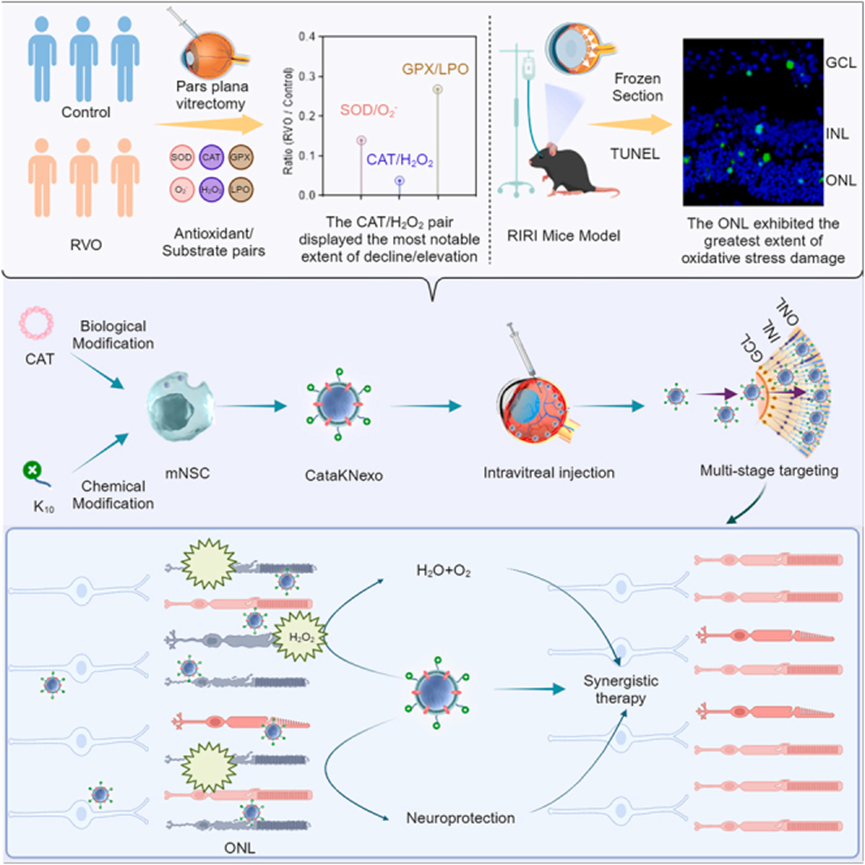
干细胞外泌体提供了全新的神经保护策略 外泌体是一种由细胞分泌的纳米级细胞外囊泡,大小在30-150纳米之间,堪称细胞间的“通信信使”。它们携带蛋白质、核酸和脂质等重要生物分子,在细胞间通讯中扮演关键角色。 干细胞外泌体具有许多独特优势:它们不会引起免疫排斥,易于储存和处理,并且能够穿过血-视网膜屏障,将活性性物质精准递送到视网膜特定细胞。 图片来自文献[2] 对于青光眼这种以视网膜神经节细胞进行性死亡为特征的疾病,干细胞外泌体提供了一种全新的神经保护策略,有望填补当前治疗手段的空白[1]: 外泌体改善青光眼的作用机制 (1)神经保护: 干细胞外泌体,尤其是间充质干细胞(MSCs)来源的外泌体,在多种青光眼模型中表现出显著的神经保护作用,通过向视网膜神经节细胞(RGCs)输送关键神经营养因子,如BDNF和GDNF,从而促进其存活和功能。 (2)免疫调节及抗炎作用: 干细胞外泌体可以通过减少视网膜中微胶质细胞激活和炎症性细胞因子的产生,调节青光眼相关的有害神经炎症。 (3)再生眼底排水系统: 小梁网是眼睛的主要排水系统,其功能障碍会导致青光眼眼中眼压升高。研究发现,干细胞外泌体可发挥再生小梁网状结构的功效。 (4)改善房水流出,降低眼压: 干细胞外泌体可以影响基质金属蛋白酶(MMPs)的表达,可促进细胞外基质(ECM)的必要重塑,从而改善房水流出,从而降低眼压。 (5)基于外泌体的药物递送,增强效果: 干细胞外泌体可被设计为复杂的药物递送系统,以增强青光眼药物的疗效。它们具有固有的生物相容性、低免疫原性,以及可能穿越血视网膜屏障(BRB)等眼球屏障的能力。使其成为将治疗药物直接输送到眼内靶向组织的理想纳米载体。将药物包裹在外泌体中还可实现持续释放,可能减少给药频率并改善患者依从性。 案例1: 直接注射干细胞外泌体治疗青光眼,促进神经保护 最近的一项研究[3]利用间充质干细胞衍生的外泌体治疗青光眼大鼠模型。 该研究将大鼠分为3组,1组为健康对照组(n = 5),另外2组为青光眼大鼠模型组,第2组(n = 30)和第3组(n = 35),其分别使用前房内微珠或小梁网的激光凝固术受伤,以诱导眼内压升高。第2组和第3组都在每周或每月的玻璃体内注射间充质干细胞衍生的外泌体或成纤维细胞外泌体。 结果表明,每周和每月玻璃体内注射间充质干细胞衍生的外泌体促进了RGCs的神经保护作用。 图片来自文献[3] 案例2: 工程化外泌体,抗氧化损伤-神经保护的双效协同 2025年5月,陶勇教授团队在《Cell Reports Medicine》上发表了一项开创性研究[4],他们开发出了精准靶向眼底的工程化干细胞外泌体,用于治疗视网膜缺血再灌注损伤——这是青光眼等视网膜缺血性疾病的典型病理过程。 研究团队基于大量临床样本发现,视网膜缺血再灌注损伤样本中过氧化氢水平大幅升高且过氧化氢酶活性明显降低。针对这一发现,他们创新设计了聚赖氨酸修饰和过氧化氢酶表达的干细胞外泌体,使工程化外泌体带有正电荷,借助眼球的电场极性实现靶向眼底的效果。 在青光眼小鼠模型和RIRI小型猪模型中,这种工程化外泌体均表现出显著的抗氧化和视神经保护作用,通过抗氧化损伤-神经保护的双效协同,部分恢复了小鼠的视网膜功能。 图片来自文献[4] 案例3: 细胞外囊泡使视网膜神经节细胞存活率提高35.08% 2025年4月发表在《Neural Regeneration Research》上的一项研究探索了源自视网膜祖细胞系R-28的细胞外囊泡对视网膜神经节细胞的保护作用[5]。 研究人员发现,R-28细胞分泌的细胞外囊泡在体外实验中可将视网膜神经节细胞存活率提高35.08%;在促进神经突生长方面,效果与阳性对照睫状神经营养因子相似。 在大鼠青光眼模型中,每周玻璃体内注射R-28细胞外囊泡,能在一定程度上保护视网膜神经节细胞,展现出神经保护的趋势。 小结 干细胞外泌体为青光眼治疗开辟了一条全新的道路,从传统的单一降低眼压模式,转向直接保护视网膜神经节细胞的神经保护策略。随着外泌体技术及工艺的不断进步和临床转化的持续推进,这种创新干预手段有望为青光眼患者带来新的希望,这可能是真正意义上实现视神经的修复和再生,而不仅仅是延缓疾病进展。在未来,我们有望看到针对不同阶段、不同类型青光眼的个性化外泌体干预方案,真正实现精准医疗在眼科领域的突破! 参考文献: [1] Beit-Yannai E. Exosomes in Ocular Health and Disease. Curr Eye Res. Published online July 23, 2025. doi:10.1080/02713683.2025.2515996 [2] Guan J, Meng F, Wang C, Zhang B, Chen J, Han J. Recent advances in engineered exosome-based therapies for ocular vascular disease. J Nanobiotechnology. 2025 Jul 19;23(1):526. doi: 10.1186/s12951-025-03589-3. PMID: 40684186; PMCID: PMC12276678. [3] Mead B, Amaral J, Tomarev S. Mesenchymal Stem Cell-Derived Small Extracellular Vesicles Promote Neuroprotection in Rodent Models of Glaucoma. Invest Ophthalmol Vis Sci. 2018 Feb 1;59(2):702-714. doi: 10.1167/iovs.17-22855. PMID: 29392316; PMCID: PMC5795911. [4]Yang W, Wang X, Zheng D, et al. Catalytic neural stem cell exosomes for multi-stage targeting and synergistical therapy of retinal ischemia-reperfusion injury. Cell Rep Med. 2025;6(4):102052. doi:10.1016/j.xcrm.2025.102052 [5]Durmaz E, Esmaeili M, Lewis P, Cimaglia G, Clayton A, Mead B. R-28 cell-derived extracellular vesicles protect retinal ganglion cells in glaucoma. Neural Regen Res. 2026;21(5):2073-2080. doi:10.4103/NRR.NRR-D-24-00709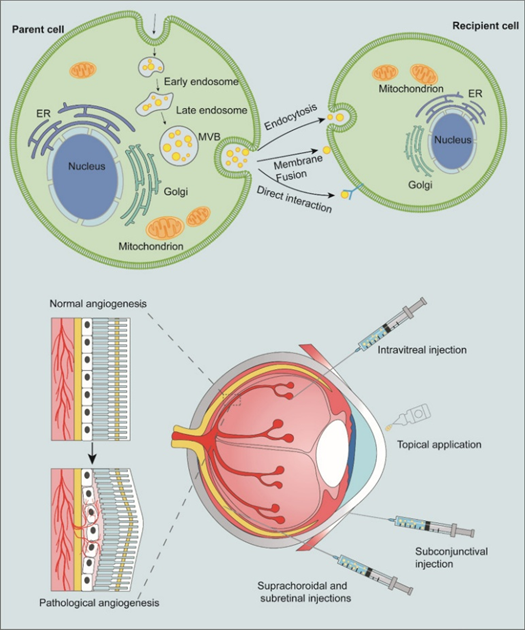

博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
