




本文重点摘要
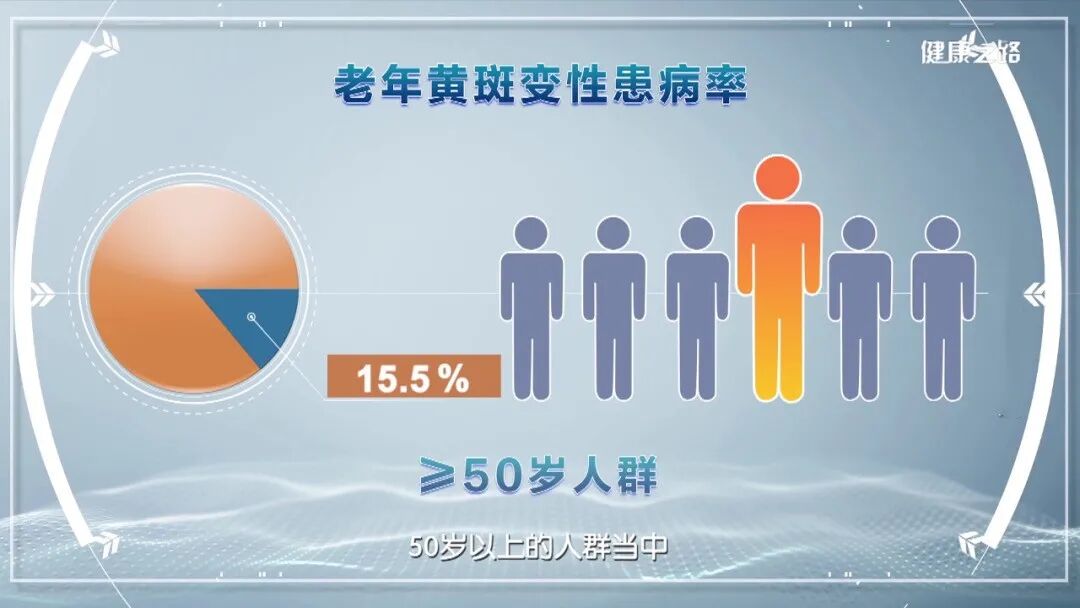
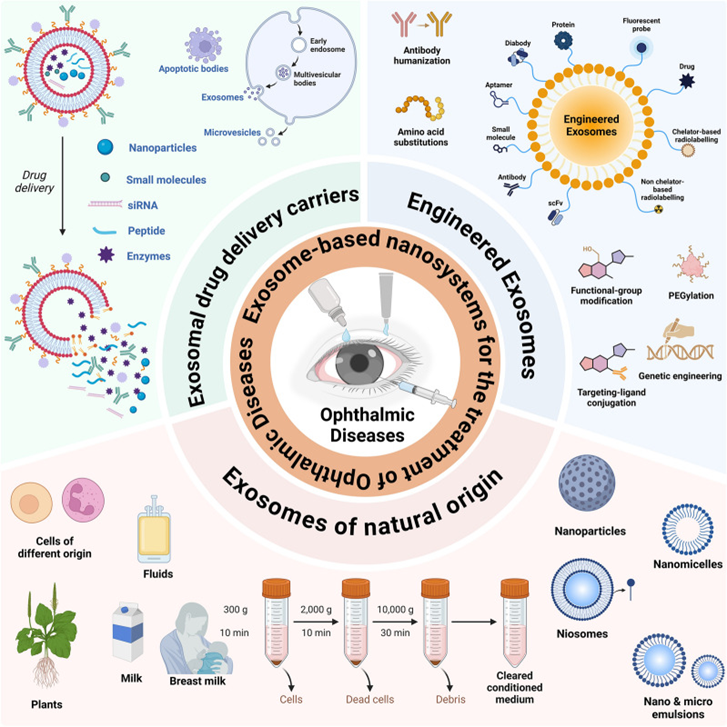
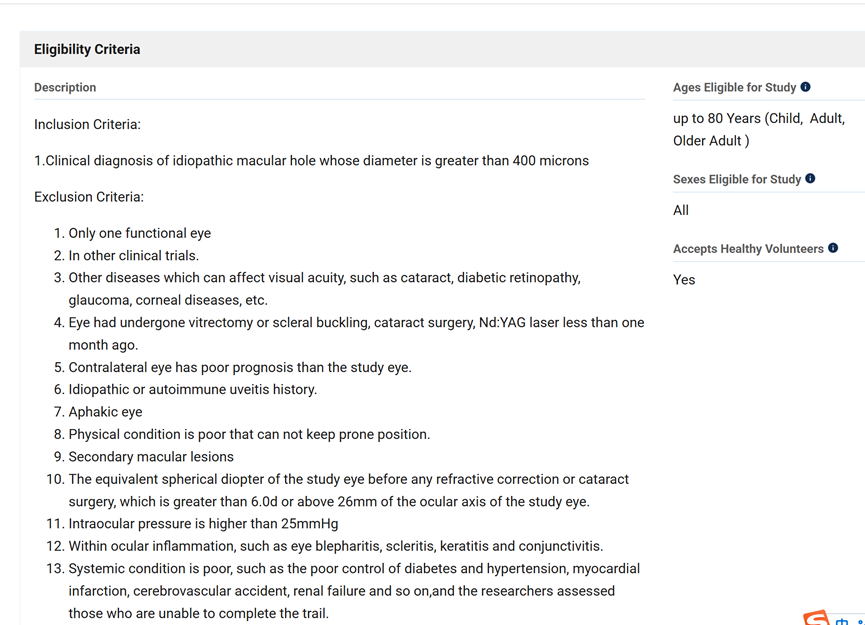
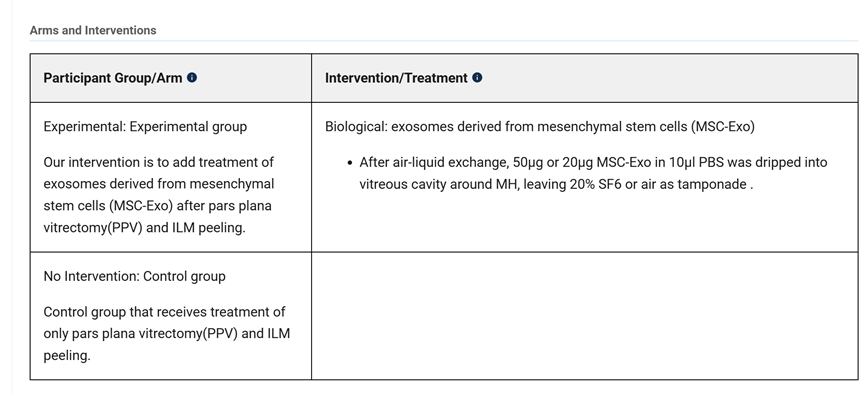
近年来,间充质干细胞外泌体被越来越多的应用到了黄斑变性等眼部疾病的治疗研究当中。本文通过汇总相关文献,为大家盘点干细胞外泌体治疗黄斑变性的临床研究进展。 研究表明: (1) 间充质干细胞来外泌体具有纳米级别、稳定性高、免疫原性低、易于获得与保存、容易穿过生物屏障进人靶器官的特性,成为了黄斑变性的治疗新方向。 (2) 间充质干细胞外泌体携带的蛋白质、脂质、miRNA等生物活性物质,可通过抗炎、抑制新生血管生成、保护视网膜光感受器细胞等方面在视网膜退行性疾病(如年龄相关性黄斑变性、视网膜色素变性)治疗中发挥作用,可能为此类疾病提供新的治疗方案。 黄斑是视力最敏锐的地方,负责精细视觉的呈现,如果把眼睛比作照相机,黄斑就是相机的底片,而人的一生只有一张这样的底片。 黄斑变性是黄斑区的退行性病变,主要影响精细视觉。主要症状包括中心视力下降、视物扭曲、视野中心出现暗点等。 黄斑变性主要包括年龄相关性黄斑变性和视网膜色素变性等类型,以视网膜色素上皮(RPE)细胞和光感受器细胞进行性损伤为主要特征。患者视功能会逐渐丧失,最终可能导致失明。 黄斑变性,尤其是年龄相关性黄斑变性(AMD),是全球老年人不可逆性视力丧失的主要原因。随着全球人口老龄化加剧,患者数量持续攀升,而传统治疗方法效果有限。 目前,临床上的治疗手段如抗血管内皮生长因子(VEGF)药物注射虽能延缓病变进展,但难以从根本上修复受损的视网膜细胞和组织。 这些传统方法往往只是延缓退化过程的发生或进展,并不能治愈疾病[1-2]。因此,迫切需要研发新型治疗手段。 近年来,干细胞外泌体这一创新疗法为黄斑变性的治疗带来了全新希望,以其独特的机制和优势成为眼科领域的研究热点。 干细胞外泌体是干细胞分泌的纳米级(30–150 nm)囊泡结构,携带蛋白质、脂质、mRNA等生物活性物质,具备更稳定、更易保存、无活细胞和低免疫原性的优点。它们的纳米级尺寸使它们能够轻松穿过血-视网膜屏障,到达病变部位,发挥治疗作用。 图片来自文献3 干细胞外泌体如何保护视网膜? 研究表明[1-2],干细胞外泌体在治疗黄斑变性中的作用机制是多方面的: 间充质干细胞外泌体治疗黄斑变性 的机制: 抑制新生血管形成:通过下调血管内皮生长因子(VEGF)的表达,有效抑制病态的脉络膜新生血管形成,这是治疗湿性AMD的关键机制。 2. 改善视网膜下纤维化:通过转运特定的生物活性物质(如miR-27b),抑制上皮-间充质转化(EMT)等过程,从而减轻和改善视网膜下的纤维化瘢痕。 3. 抗炎作用:能够抑制视网膜组织的炎症反应,减轻炎症环境对视网膜细胞的损害,为组织修复创造有利条件。 4. 调节免疫与细胞活化:通过抑制小胶质细胞(视网膜中的主要免疫细胞)的过度活化,来维持视网膜内部的免疫稳定,防止神经炎症进一步加剧损伤。 5. 促进修复与再生:通过递送必需的miRNA和蛋白质等物质,启动并增强对眼组织恢复和愈合至关重要的再生过程,从根本上促进细胞修复。 6.抑制光感受器凋亡:研究发现,间充质干细胞外泌体抑制光感受器细胞凋亡,维持正常的视网膜结构。进一步蛋白质组学分析显示间充质干细胞外泌体中含有抗炎、神经保护和抗凋亡作用的蛋白。 干细胞外泌体治疗黄斑变性临床研究进展 在干细胞外泌体治疗黄斑变性的研究领域,目前的主要突破集中在对疾病关键机制的深入理解和外泌体技术的应用上。 临床类型一:干细胞外泌体直接应用于黄斑变性治疗 在ClinicalTrials.gov上注册的一项研究探讨了间充质干细胞衍生的外泌体促进大型和难治性黄斑裂孔愈合的安全性和有效性。 虽然黄斑裂孔与黄斑变性不同,但这项研究为干细胞外泌体在黄斑变性等眼底疾病治疗中的应用提供了临床证据。 这项临床试验研究年龄为小于80岁的患者,包括儿童、成人以及老年人。 主要干预措施为: 治疗组:在玻璃体切割手术(PPV)和内界膜剥离后增加来自间充质干细胞(MSC-Exo)的外泌体的治疗。 对照组:仅行玻璃体部分切除(PPV)和内界膜剥离。 这项临床假设:MSC和MSC- exo治疗能促进MH的功能和解剖恢复。MSC- exo治疗可能是一种有效和安全的方法,可以改善难治性MH手术后的视力结果。 让我们共同期待后期更多的临床数据发布。 一项2025年3月发表于《Free Radical Biology and Medicine》的研究揭示[5],间充质干细胞外泌体能够调节干性年龄相关性黄斑变性中Müller神经胶质细胞的神经发生潜能。 特别值得注意的是,研究人员构建了载有长链非编码RNA H19(LncRNA H19)的工程化外泌体。 研究发现,这种工程化外泌体能够更有效地激活Wnt/β-catenin信号通路,同时更强地抑制TGFβ1信号通路,从而在促进Müller细胞去分化、抑制其胶质化和向上皮细胞转化方面,展现出比普通外泌体更强的能力,为干性黄斑变性的治疗提供了新的理论依据和潜在工具。 临床类型二:干细胞外泌体载药,潜在的1+1>2的新方案 一项2025年9月发表在《Journal of Drug Delivery Science and Technology》的研究[4],首次提出利用人脐带间充质干细胞来源的外泌体负载抗炎药物塞来昔布,用于治疗激光诱导的兔脉络膜新生血管(CNV)模型。该策略巧妙结合了外泌体的内在生物活性与塞来昔布的强效抗炎、抗血管生成作用。 实验结果表明,这种载药外泌体能显著抑制CNV面积(减少60.43%)和荧光渗漏(减少75.95%),其效果优于游离塞来昔布、单纯外泌体及临床常用的抗VEGF药物贝伐珠单抗,为新生血管性年龄相关性黄斑变性(nAMD)提供了一种兼具再生修复与精准治疗潜力的协同治疗新方案。 小结 干细胞外泌体作为一种创新的无细胞治疗策略,为黄斑变性的治疗带来了新的希望。未来,仍需开展更多的研究探讨其中的机制,还需解决当前干细胞外泌体大规模和高纯度提取有限的技术问题,以及开展更大规模的临床试验验证干细胞外泌体治疗黄斑变性的长期安全性和有效性。随着科学技术的不断进步和临床研究的深入,我们有理由相信,这种纳米级的"修复工具箱"将在未来为更多黄斑变性患者带来光明。 参考文献: [1] Liao HJ, Yang YP, Liu YH, et al. Harnessing the potential of mesenchymal stem cells-derived exosomes in degenerative diseases. Regen Ther. 2024;26:599-610. Published 2024 Aug 20. doi:10.1016/j.reth.2024.08.001 [2] https://www.thepaper.cn/newsDetail_forward_31193797?commTag=true [3] Guan J, Meng F, Wang C, Zhang B, Chen J, Han J. Recent advances in engineered exosome-based therapies for ocular vascular disease. J Nanobiotechnology. 2025;23(1):526. Published 2025 Jul 19. doi:10.1186/s12951-025-03589-3 [4]Liu, J., Srivastava, S., Li, T., Moujane, F., Lee, J. Y., Chen, Y., Liu, H., & Deng, S. X. (2025). Mesenchymal stem cell-derived exosomes loaded with Celecoxib improve laser-induced choroidal neovascularization in a rabbit model. Journal of Drug Delivery Science and Technology. [5]Tang Y, Cheng C, Ding R, et al. MSC exosomes and MSC exosomes loaded with LncRNA H19 as nanotherapeutics regulate the neurogenetic potential of Müller Glial Cells in dry age-related macular degeneration. Free Radic Biol Med. 2025;231:178-192. doi:10.1016/j.freeradbiomed.2025.02.039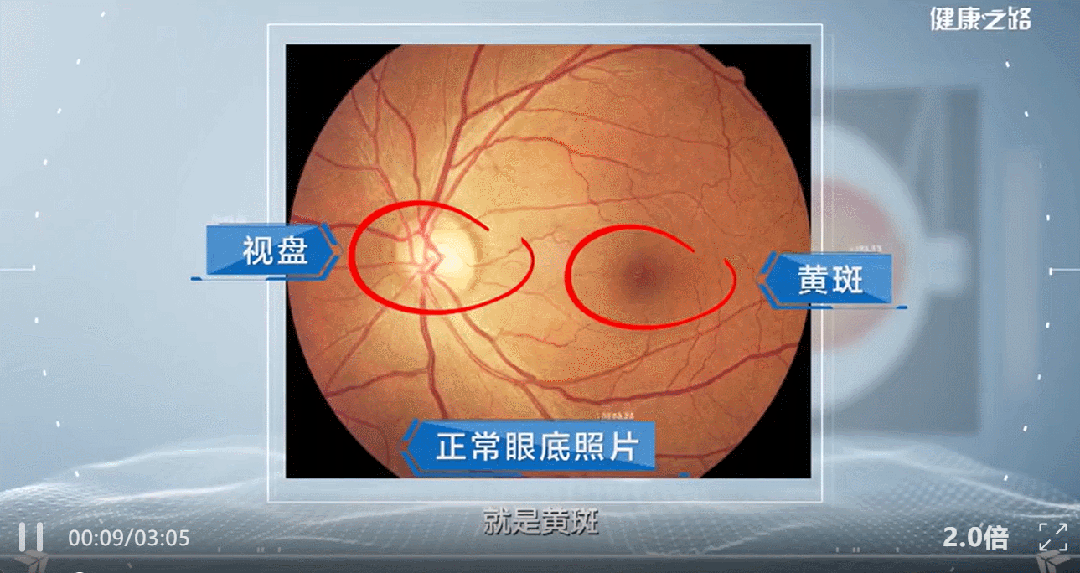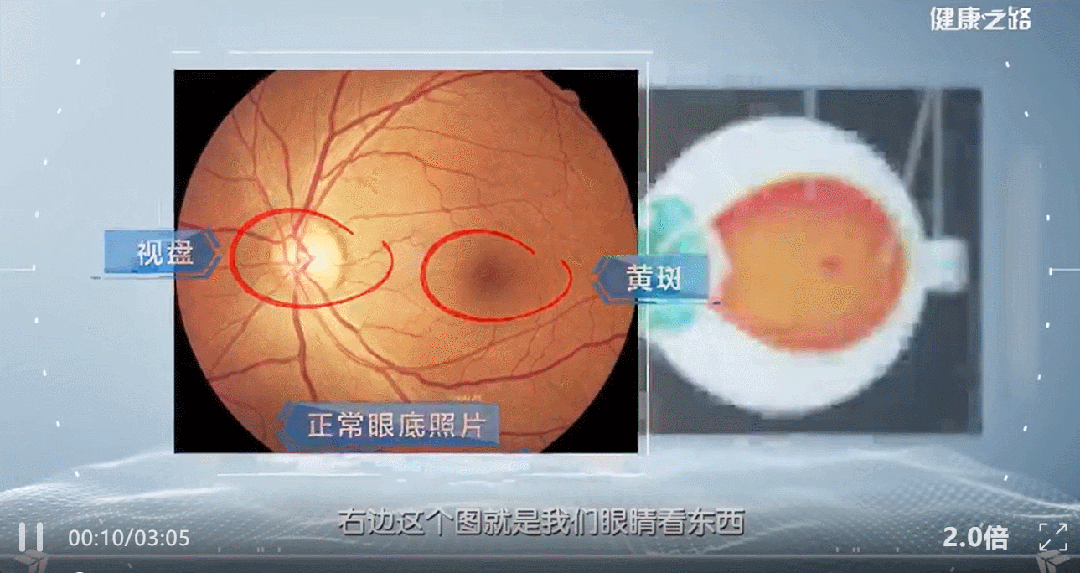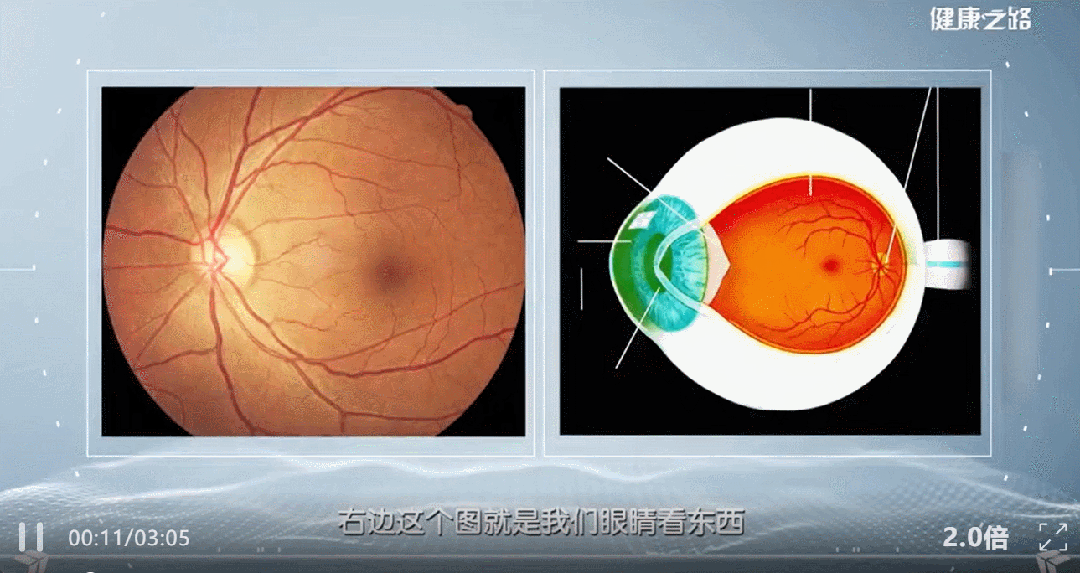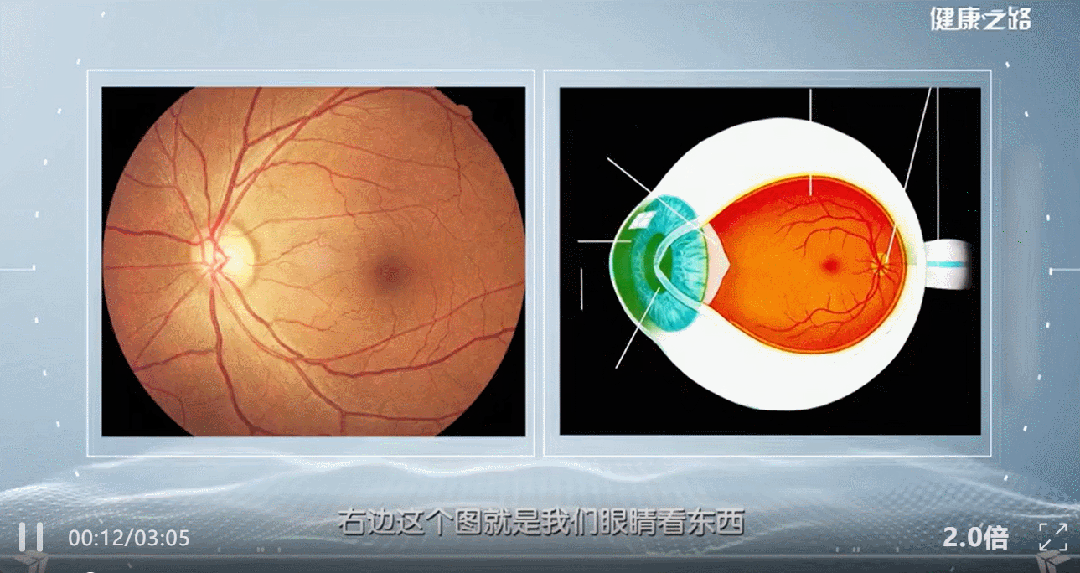


相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
