




引言
卵巢是女性生殖系统最早老去的器官。卵巢衰老是全身衰老的加速器。研究证实,间充质干细胞(MSCs)可以有效帮助女性生育力恢复, 卵巢回春。在最新发表一篇系统回顾中,作者选取了截至 2023 年 6 月,关于MSC保护卵巢储备免受损伤和衰老的相关的112项研究,结果表明,不同类型的MSCs可以改善卵泡的存活和生存质量,还能够逆转化疗引起的卵巢损伤,并通过促进卵巢血管的再生长来改善卵泡池的存活。
卵巢在维持女性正常机体功能方面起着至关重要的重要,卵巢早衰(POF)在35岁之前每250名女性中就有1名,在40岁之前每100名女性中就有1名。卵巢早衰不仅会影响生育,还会引起内分泌、皮肤、精神等全身健康问题,例如增加心血管疾病、骨质疏松症和性功能障碍的发生风险。

卵巢早衰是指妇女在40岁以前出现闭经、不育、雌激素缺乏以及促性腺激素水平升高为特征的一种疾病,其导致的低雌激素水平及生育力丧失已成为妇女生殖健康的两大威胁。
最近,卵巢早衰与断崖式衰老的关联性也引发了人们的关注。去年,山东一女子发视频称,自己被诊断为卵巢早衰后“断崖式衰老”,看起来像70多岁的。卵巢是女性生殖系统最早老去的器官。卵巢衰老是全身衰老的加速器。

卵巢与女性健康以及衰老息息相关。近年来,越来越多的研究证实,间充质干细胞(MSCs)可以有效帮助女性生育力恢复, 使卵巢回春。
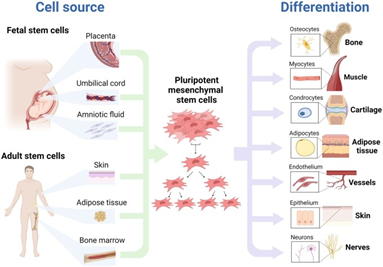
卵巢是如何衰老的? 女性生殖系统衰老与氧化应激损伤息息相关。与衰老同时发生的抗氧化剂防御能力下降,也可导致女性生殖系统因氧化损伤而丧失正常功能。 生物活性氧(ROS),包括超氧阴离子、羟基自由基、过氧化氢、烷氧基和过氧化氢,是线粒体氧化代谢和细胞对外源反应过程中氧不完全还原产生的[1]。ROS无时无刻不在侵蚀着机体,对女性生殖系统也不例外。 ROS 在哺乳动物卵巢中带来积极和消极的影响。ROS影响卵巢的各种生理和病理功能,如卵巢类固醇生成、卵泡生长、卵母细胞成熟、排卵、受精、着床和妊娠期黄体维持等[2]。 在正常状态下,自由基和抗氧化剂的数量处于平衡状态。然而,当产生过多的自由基时,抗氧化防御就会失败,健康细胞会因氧化应激而受损。氧化应激会给卵巢、子宫、卵母细胞和胚胎带来有害后果,导致女性生殖异常,常表现为卵巢早衰和多囊卵巢综合征。 生殖系统衰老为女性自然受孕带来显著影响,卵巢衰老、子宫衰老成为困扰万千女性的难题。间充质干细胞的抗氧化应激性能,可以为抗女性生殖系统衰老和辅助生殖技术提供给强而有效的干预措施。 图片引自文献3 氧化应激对女性生殖器官、卵母细胞和胚胎的有害影响 间充质干细胞对抗卵巢衰老的优势 间充质干细胞(Mesenchymal Stem Cells,MSCs)是一类多潜力干细胞,它们能够分化为多种类型的细胞,包括骨骼、软骨、肌肉和脂肪细胞。 图片引自文献4 间充质干细胞的来源及其分化能力 MSCs在生殖医学中的应用广泛,在对抗女性生殖系统衰老和抗氧化中,MSCs的优势主要集中于以下几个方面: 112项研究表明:MSCs逆转卵巢损伤和衰老 在最新发表一篇系统回顾中,作者选取了截至 2023 年 6 月,关于MSC保护卵巢储备免受损伤和衰老的相关112项研究,结果表明,不同类型的MSCs已经过测试,可以改善卵泡的存活和生存质量,还能够逆转化疗引起的卵巢损伤,并通过促进卵巢血管的再生长来改善卵泡池的存活[9]。 大量研究证实了MSC在卵巢衰老模型和卵巢损伤模型中的有益效应。 首先,针对MSC的归巢能力,这些研究给出了确切的答案。MSC可以在卵巢中长期留存,并且随着时间的推移会持续存在,而不被免疫系统清除[10]。 事实上,卵巢中的颗粒细胞(GC)还能够摄取MSC衍生的外泌体[11]。实验证明,外泌体可以帮助人类 GC 增殖增加和凋亡减少,并在损伤的小鼠模型中提高卵泡存活率。总共有 24 项研究仔细研究了 MSC 对体外培养的 GC 的影响。所有研究均检测到与 MSC 共培养时 GC 细胞凋亡减少。一些研究还研究了共培养对 GC 增殖的影响,要么直接证明增殖率增加,要么观察信号通路的激活。此外,在所有使用啮齿动物卵巢组织的研究中,都观察到对体外卵泡数量的积极影响,显示卵泡生长增加或具有正常形态的更多卵泡。 同样,MSC 也被证明可以有效促进卵巢组织移植中移植部位的血运重建。 在临床方面,2016年Edessy等人通过卵巢内注射 BM-MSC 获得了第一批自然妊娠婴儿[12]。此后,不断有应用MSCs帮助女性恢复卵巢功能或成功受孕的相关研究结果被报道。这些研究明确MSCs治疗对改善月经周期、提高卵巢功能指标以及增加妊娠率有积极影响。 MSCs治疗生殖系统衰老的有效性已经通过多项基础和临床研究得到了初步的证实。但仍然需要更多的高质量、大规模的临床试验来验证MSCs治疗的有效性和安全性,并确定最佳的治疗方案。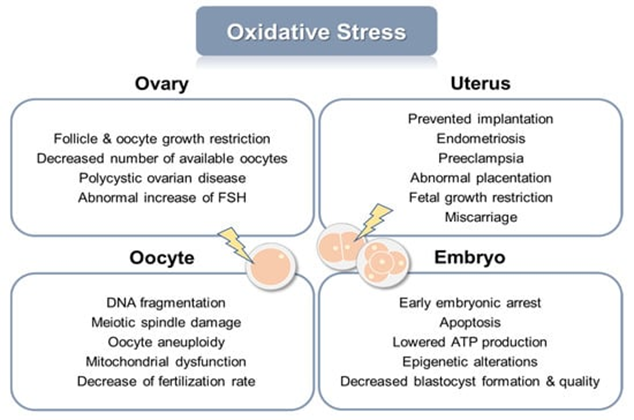
间充质干细胞对抗卵巢早衰的机制:
1. 旁分泌效应:MSCs能分泌多种生长因子、细胞因子和抗炎物质,如表皮生长因子(EGF)、纤维母细胞生长因子(FGF)、血管内皮生长因子(VEGF)和白细胞介素(ILs)等[5],这些因子在控制细胞增殖和凋亡率方面发挥着至关重要的作用,能够促进受损组织的再生和修复,同时增强抗氧化能力,减少氧化应激造成的损伤。
2. 抗氧化应激:MSCs能够通过调节抗氧化酶系统,如上调超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和催化酶(CAT)的表达,来清除自由基,保护细胞免受氧化应激的损害[6]。在衰老诱导的小鼠模型中,脂肪间充质干细胞可通过调节衰老相关标记物表现出抗氧化作用[7]。
3. 免疫调节:MSCs具有免疫调节功能,能够通过抑制T细胞增殖和活化、调节巨噬细胞极化等方式[8],抑制过度的免疫反应和炎症,维护生殖系统的免疫平衡,预防因免疫失调导致的生殖功能障碍。这对于维持生殖系统的正常功能和防止早衰非常重要。
4. 抗纤维化:纤维化是衰老相关的一个重要特征,它会影响组织的弹性和功能。MSCs能够抑制纤维化过程,通过调节细胞外基质的沉积和重塑,维持生殖器官的结构和功能,延缓生殖系统衰老。

小结
一系列研究提供了有关间充质干细胞治疗卵巢早衰等生殖系统衰老的积极信号,间充质干细胞对抗女卵巢早衰和抗氧化应激的作用均有了科学依据。间充质干细胞可以改善卵巢功能、增加卵泡数量、提高性激素水平、减少颗粒细胞凋亡,可用于治疗卵巢早衰和不孕症。未来仍需关注优化间充质干细胞的分离、培养和移植等策略,以实现更高效的治疗效果,帮助更多的女性走出卵巢早衰的困扰。
参考文献:
[1] Pham-Huy, L.A.; He, H.; Pham-Huy, C. Free radicals, antioxidants in disease and health. Int. J. Biomed. Sci. 2008, 4, 89–96.
[2] Lu, J.; Wang, Z.; Cao, J.; Chen, Y.; Dong, Y. A novel and compact review on the role of oxidative stress in female reproduction. Reprod. Biol. Endocrinol. 2018, 16, 80.
[3] Ra, K.; Park, S.C.; Lee, B.C. Female Reproductive Aging and Oxidative Stress: Mesenchymal Stem Cell Conditioned Medium as a Promising Antioxidant. Int. J. Mol. Sci. 2023, 24, 5053.
[4] Cacciottola L, Vitale F, Donnez J, Dolmans MM. Use of mesenchymal stem cells to enhance or restore fertility potential: a systematic review of available experimental strategies. Hum Reprod Open. 2023 Oct 25;2023(4):hoad040. doi: 10.1093/hropen/hoad040. PMID: 37954935; PMCID: PMC10637864.
[5] Wei, X.; Yang, X.; Han, Z.P.; Qu, F.F.; Shao, L.; Shi, Y.F. Mesenchymal stem cells: A new trend for cell therapy. Acta Pharmacol. Sin. 2013, 34, 747–754.
[6] de Godoy, M.A.; Saraiva, L.M.; de Carvalho, L.R.P.; Vasconcelos-Dos-Santos, A.; Beiral, H.J.V.; Ramos, A.B.; Silva, L.R.P.; Leal, R.B.; Monteiro, V.H.S.; Braga, C.V.; et al. Mesenchymal stem cells and cell-derived extracellular vesicles protect hippocampal neurons from oxidative stress and synapse damage induced by amyloid-beta oligomers. J. Biol. Chem. 2018, 293, 1957–1975.
[7] Zhang, S.; Dong, Z.; Peng, Z.; Lu, F. Anti-aging effect of adipose-derived stem cells in a mouse model of skin aging induced by D-galactose. PLoS ONE 2014, 9, e97573.
[8] Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease. Nat Rev Immunol. 2008 Sep;8(9):726-36. doi: 10.1038/nri2395. PMID: 19172693.
[9] Cacciottola L, Vitale F, Donnez J, Dolmans MM. Use of mesenchymal stem cells to enhance or restore fertility potential: a systematic review of available experimental strategies. Hum Reprod Open. 2023 Oct 25;2023(4):hoad040. doi: 10.1093/hropen/hoad040. PMID: 37954935; PMCID: PMC10637864.
[10] Ling L, Feng X, Wei T, Wang Y, Wang Y, Wang Z, Tang D, Luo Y, Xiong Z. Human amnion-derived mesenchymal stem cell (hAD-MSC) transplantation improves ovarian function in rats with premature ovarian insufficiency (POI) at least partly through a paracrine mechanism. Stem Cell Res Ther. 2019 Jan 25;10(1):46. doi: 10.1186/s13287-019-1136-x. PMID: 30683144; PMCID: PMC6347748.
[11] Huang B, Lu J, Ding C, Zou Q, Wang W, Li H. Exosomes derived from human adipose mesenchymal stem cells improve ovary function of premature ovarian insufficiency by targeting SMAD. Stem Cell Res Ther. 2018 Aug 9;9(1):216. doi: 10.1186/s13287-018-0953-7. PMID: 30092819; PMCID: PMC6085638.
[12] Liu T, Huang Y, Zhang J, Qin W, Chi H, Chen J, Yu Z, Chen C.. Transplantation of human menstrual blood stem cells to treat premature ovarian failure in mouse model. Stem Cells Dev 2014b;23:1548–1557.
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
