




近年来,间充质干细胞治疗缺血性心肌病的临床试验已被广泛开展。日前,发表在《Stem cell research & therapy》杂志上的综述对多项间充质干细胞治疗缺血性心肌病的临床试验进行了概述[1],认为基于间充质干细胞的疗法具有一定的安全性和有效性,给药途径、干细胞来源和剂量等是未来临床应用发展的思考要点,未来临床发展仍可突破。

心血管疾病发病率高、死亡率高,仍然是导致全球性死亡的主要原因,冠心病是其中最常见的一种。冠心病引起的心肌长期缺血往往会导致缺血性心肌病。目前,已在缺血性心肌病中检测到不同程度的心肌功能障碍和纤维化。在过去的几十年中,针对缺血性心肌病的治疗重点是缓解症状、预防疾病进展以及提高生存率和生活质量。
间充质干细胞能够分泌多种具有抗炎和免疫调节活性的分子,具有抗纤维化、抗炎、抗凋亡、免疫调节和促血管生成等特性,可刺激受损心肌的修复和再生,被认为是在心肌修复和再生领域很有前景的治疗手段。
在扩张型心肌病患者中,间充质干细胞通过恢复内皮功能来改善心脏功能,进而增强冠状动脉循环。在缺血性心肌病患者中,间充质干细胞通过抗纤维化作用来减少疤痕并逆转左心室重构。
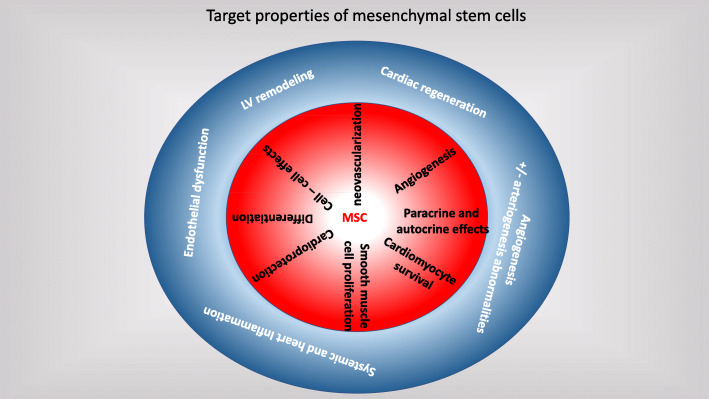
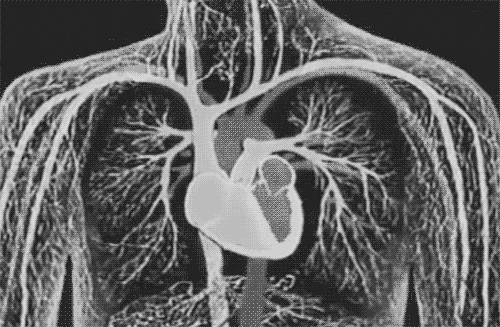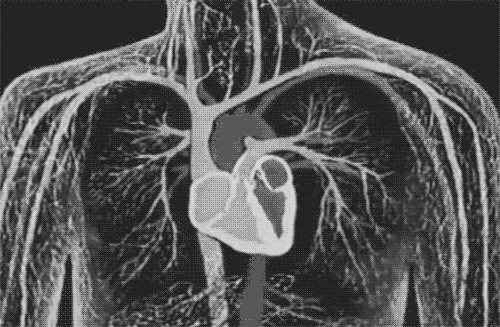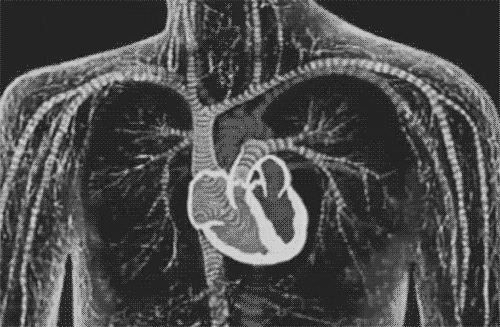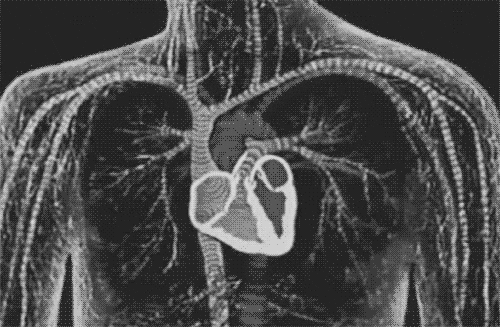
图片来自文献[1]
间充质干细胞作用机制(红色圆圈)与射血分数降低心力衰竭关键成分(蓝色圆圈)的关系
间充质干细胞的再生能力归因于其旁分泌。间充质干细胞不仅分泌多种生长因子,如胰岛素样生长因子-1、血管内皮生长因子和成纤维细胞生长因子,还表达多种细胞因子,如血管生成素-1、白介素-1、白介素-6和纤溶酶原激活剂,这些因子能以多种方式刺激心肌细胞增殖。
间充质干细胞能够分化为内皮细胞、平滑肌细胞,还能改善心脏重要细胞成分常驻心肌细胞的功能。缺血动物模型中的间充质干细胞疗法导致心肌梗死后心室泵功能改善、瘢痕组织减少和新血管生成[2]。
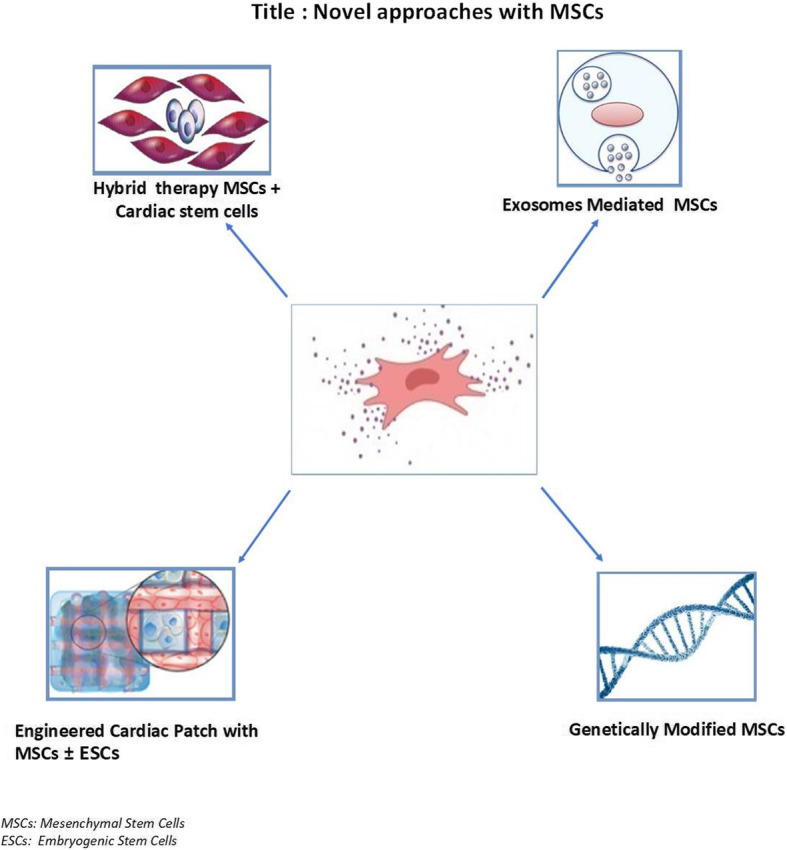
图片来自文献[1]
将细胞、外泌体介导的间充质干细胞和工程心脏贴片与 MSC +/- ESC 相结合的混合疗法是改善心脏修复和再生的未来方法。(MSC间充质干细胞、ESC胚胎干细胞)
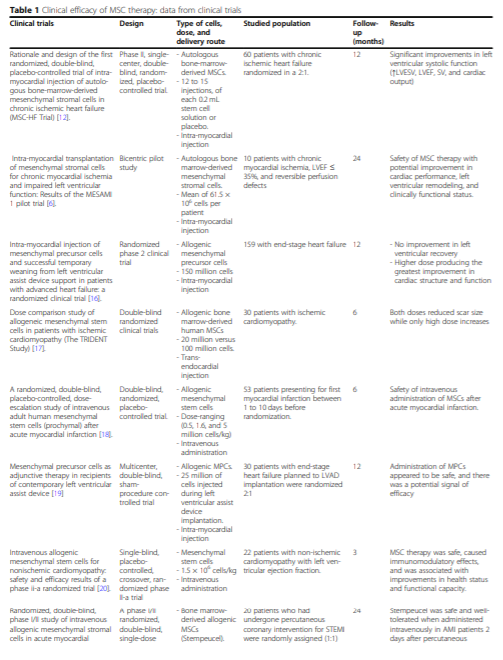
图片来自文献[1]
间充质干细胞治疗的临床疗效
近年来,间充质干细胞在急性和陈旧性心肌梗死的治疗研究领域被广泛采纳。在动物模型中,间充质干细胞治疗急性和陈旧性心肌梗死取得了较好的结果 [3],同时在人体临床试验中也取得了较好的结果。
有研究表明间充质干细胞疗法能使得梗死面积减小、左心室反向重构、局部心肌壁收缩性改善、舒张末期和收缩末期容积(LVEDV/LVESV)减少。在2015年发表的文献中[4], ST 段抬高心肌梗死 (STEMI) 患者接受冠状动脉间充质干细胞注射6 个月后,心肌灌注和整体心脏功能改善,并且具有良好的安全性。2014年发表的文献也已经证明了心肌内注射间充质前体细胞对终末期心力衰竭患者的安全性和有效性迹象[5]。
不过,也有一些研究得出了不一样的结论,例如2015年发表在Cytotherapy上的研究发现静脉注射骨髓来源的间充质干细胞后ST 段抬高心肌梗死患者并没有得到临床获益[6]。
未来仍然需要开展更多的临床研究来探讨间充质干细胞在缺血性心肌病领域的应用。
目前,间充质干细胞治疗心肌病仍处在临床研究阶段,在进入大规模临床应用之前仍然需要考虑诸多因素,其中就包括了采用自体和异体干细胞的问题、给药途径和细胞的制备等。
关于采用自体与异体干细胞的问题,可根据具体的疾病来判断。由于缺乏主要的组织相容性复合物 II 类和共刺激因素,间充质干细胞被认为具有免疫特权。此外,研究表明,间充质干细胞的旁分泌信号可防止它们被淋巴细胞破坏。然而,由于免疫系统的清除作用,同种异体间充质干细胞可能会触发同种异体抗体的产生。年龄较大和并存的心血管危险因素等,也可能会影响自体间充质干细胞的功能[7]。
在急性冠状动脉疾病中,同种异体间充质干细胞比自体间充质干细胞更受青睐,因为它可立即获得;而在慢性冠状动脉疾病中,自体间充质干细胞是最佳选择[8]。
另一个重要的思考方向是细胞的制备和给药途径等问题。移植细胞的活力和给药途径,影响着间充质干细胞的临床疗效,从而也给临床应用带来一定的影响。
急性心肌梗死后,受损心肌组织的微环境氧浓度低、自由基浓度高,被认为对移植细胞有害[9]。移植的细胞需要外渗才能到达受伤的心肌,冠状动脉内输注会稀释间充质干细胞,降低疗效[10]。此外,冠状动脉内注射的间充质干细胞,只有少数保留在心肌中,大部分进入了全身血液循环中[11]。
另一方面,间充质干细胞的制备,包括分离、培养、接种、储存等也会影响细胞的治疗特性,从而对治疗结果也产生一定的影响[12]。
小结:
尽管缺血性心肌病的治疗策略不断发展,但在改善生存率和生活质量方面仍然有限。间充质干细胞具有使心肌细胞在心肌损伤后再生的能力,是一种有前景的缺血性心肌病疗法。已有研究证明间充质干细胞疗法在缺血性心肌病中的安全性和有效性。不过,临床试验结果存在的差异性仍然需要我们去探讨,未来仍然需要不断的探索和研究以达成临床共识和制定标准化的使用方法。
参考文献:
[1] Razeghian-Jahromi, I., Matta, A. G., Canitrot, R., Zibaeenezhad, M. J., Razmkhah, M., Safari, A., Nader, V., & Roncalli, J. (2021). Surfing the clinical trials of mesenchymal stem cell therapy in ischemic cardiomyopathy. Stem cell research & therapy, 12(1), 361. https://doi.org/10.1186/s13287-021-02443-1
[2] Mathiasen, A. B., Haack-Sørensen, M., & Kastrup, J. (2009). Mesenchymal stromal cells for cardiovascular repair: current status and future challenges. Future cardiology, 5(6), 605–617. https://doi.org/10.2217/fca.09.42
[3] Perin, E. C., Sanz-Ruiz, R., Sánchez, P. L., Lasso, J., Pérez-Cano, R., Alonso-Farto, J. C., Pérez-David, E., Fernández-Santos, M. E., Serruys, P. W., Duckers, H. J., Kastrup, J., Chamuleau, S., Zheng, Y., Silva, G. V., Willerson, J. T., & Fernández-Avilés, F. (2014). Adipose-derived regenerative cells in patients with ischemic cardiomyopathy: The PRECISE Trial. American heart journal, 168(1), 88–95.e2. https://doi.org/10.1016/j.ahj.2014.03.022
[4] Premer, C., Blum, A., Bellio, M. A., Schulman, I. H., Hurwitz, B. E., Parker, M., Dermarkarian, C. R., DiFede, D. L., Balkan, W., Khan, A., & Hare, J. M. (2015). Allogeneic Mesenchymal Stem Cells Restore Endothelial Function in Heart Failure by Stimulating Endothelial Progenitor Cells. EBioMedicine, 2(5), 467–475. https://doi.org/10.1016/j.ebiom.2015.03.020
[5] Ascheim, D. D., Gelijns, A. C., Goldstein, D., Moye, L. A., Smedira, N., Lee, S., Klodell, C. T., Szady, A., Parides, M. K., Jeffries, N. O., Skerrett, D., Taylor, D. A., Rame, J. E., Milano, C., Rogers, J. G., Lynch, J., Dewey, T., Eichhorn, E., Sun, B., Feldman, D., … Woo, Y. J. (2014). Mesenchymal precursor cells as adjunctive therapy in recipients of contemporary left ventricular assist devices. Circulation, 129(22), 2287–2296. https://doi.org/10.1161/CIRCULATIONAHA.113.007412
[6] Chullikana, A., Majumdar, A. S., Gottipamula, S., Krishnamurthy, S., Kumar, A. S., Prakash, V. S., & Gupta, P. K. (2015). Randomized, double-blind, phase I/II study of intravenous allogeneic mesenchymal stromal cells in acute myocardial infarction. Cytotherapy, 17(3), 250–261. https://doi.org/10.1016/j.jcyt.2014.10.009
[7] Kinkaid, H. Y., Huang, X. P., Li, R. K., & Weisel, R. D. (2010). What's new in cardiac cell therapy? Allogeneic bone marrow stromal cells as "universal donor cells". Journal of cardiac surgery, 25(3), 359–366. https://doi.org/10.1111/j.1540-8191.2009.00984.x
[8] Mathiasen, A. B., Jørgensen, E., Qayyum, A. A., Haack-Sørensen, M., Ekblond, A., & Kastrup, J. (2012). Rationale and design of the first randomized, double-blind, placebo-controlled trial of intramyocardial injection of autologous bone-marrow derived Mesenchymal Stromal Cells in chronic ischemic Heart Failure (MSC-HF Trial). American heart journal, 164(3), 285–291. https://doi.org/10.1016/j.ahj.2012.05.026
[9] Brodarac, A., Šarić, T., Oberwallner, B., Mahmoodzadeh, S., Neef, K., Albrecht, J., Burkert, K., Oliverio, M., Nguemo, F., Choi, Y. H., Neiss, W. F., Morano, I., Hescheler, J., & Stamm, C. (2015). Susceptibility of murine induced pluripotent stem cell-derived cardiomyocytes to hypoxia and nutrient deprivation. Stem cell research & therapy, 6(1), 83. https://doi.org/10.1186/s13287-015-0057-6
[10] Trachtenberg, B., Velazquez, D. L., Williams, A. R., McNiece, I., Fishman, J., Nguyen, K., Rouy, D., Altman, P., Schwarz, R., Mendizabal, A., Oskouei, B., Byrnes, J., Soto, V., Tracy, M., Zambrano, J. P., Heldman, A. W., & Hare, J. M. (2011). Rationale and design of the Transendocardial Injection of Autologous Human Cells (bone marrow or mesenchymal) in Chronic Ischemic Left Ventricular Dysfunction and Heart Failure Secondary to Myocardial Infarction (TAC-HFT) trial: A randomized, double-blind, placebo-controlled study of safety and efficacy. American heart journal, 161(3), 487–493. https://doi.org/10.1016/j.ahj.2010.11.024
[11] Penicka, M., Widimsky, P., Kobylka, P., Kozak, T., & Lang, O. (2005). Images in cardiovascular medicine. Early tissue distribution of bone marrow mononuclear cells after transcoronary transplantation in a patient with acute myocardial infarction. Circulation, 112(4), e63–e65. https://doi.org/10.1161/CIRCULATIONAHA.104.496133
[12] Pountos, I., Corscadden, D., Emery, P., & Giannoudis, P. V. (2007). Mesenchymal stem cell tissue engineering: techniques for isolation, expansion and application. Injury, 38 Suppl 4, S23–S33. https://doi.org/10.1016/s0020-1383(08)70006-8
相关新闻
博雅新闻
行业政策

在线咨询
留言您的联系方式及需求,专业顾问将于收到资料后尽快与您回复。
我要预约
填写您的预约需求,您将获得相应的专业顾问满足您的需求。
电话咨询
全国统一客服专线400-885-0012,期待为您服务。
微信咨询
直接添加客服微信号,专业顾问随时准备解答您的一切疑问。
在线咨询



服务热线
400-885-0012


官方微信



TOP

观望只会错过守护宝宝和家庭的机会
存储新生儿干细胞
机会一生只有一次

扫码了解细胞新时代
